Pembahasan Materi Perbedaan Asam Basa dan Garam Beserta Contohnya
Klasifikasi zat berdasarkan sifat keasamannya dapat dibedakan menjadi 3, yaitu: Asam, Basa, dan Garam.
Mari kita bahas satu persatu dari masing - masing zat tersebut.
#1. Asam
Asam adalah senyawa yang mengandung ion Hidrogen (H+) dan karakteristiknya memiliki rasa asam. Zat ini dalam wujud cair dapat menghantarkan arus listrik.
Klasifikasi Asam
Berdasarkan asalnya, asam dibedakan menjadi 2, yaitu Asam Alami dan Asam Sintetis.
Asam alami merupakan asam yang terdapat secara alami di alam, contohnya di dalam buah dan sayur.
Sedangkan Asam sintetis merupakan asam buatan yang diproduksi oleh pabrik atau di laboratorium.
Berdasarkan tingkat keasamannya, asam dibedakan menjadi Asam Kuat dan Asam Lemah.
Asam Kuat merupakan asam yang secara umum diproduksi pabrik, disebut juga asam sintetis. Asam Lemah merupakan asam yang secara umum terdapat di dalam buah - buahan.
Asam kuat bersifat korosif, artinya senyawa golongan ini dapat merusak logam menjadi berkarat dan hancur.
Selain itu, asam kuat juga dapat merusak kulit jika terkena langsung ke permukaan kulit (melepuh).
Berikut adalah contoh senyawa asam yang sering kita temukan dalam kehidupan sehari - hari.
1). Asam asetat/ cuka (CH3COOH), Asam Lemah yang terdapat pada larutan cuka.
2). Asam askorbat (C6H8O6), Asam Lemah yang terdapat pada buah jeruk, tomat, dan vitamin C.
3). Asam sitrat (C6H8O7), Asam Lemah yang terdapat pada jeruk dan permen.
4). Asam karbonat (H2CO3), Asam Kuat yang terdapat pada minuman.
5). Asam nitrat (HNO3), Asam Kuat yang terdapat pada pupuk.
6). Asam fosfat (H3PO4), Asam Kuat yabg terdapat pada detergen dan pupuk.
7). Asam formiat (HCOOH), Asam Lemah yang terdapat pada sengatan lebah.
8). Asam laktat (C3H6O3), Asam Lemah yang terdapat pada keju dan yoghurt.
9). Asam borat (H3BO3), Asam Lemah yang terdapat pada larutan pencuci mata.
10). Asam malat (C4H6O5), Asam Lemah yang terdapat pada apel.
11). Asam sulfat (H2SO4), Asam Kuat yang terdapat pada cairan aki.
12). Asam klorida (HCl), Asam Kuat yang terdapat pada lambung, disebut juga asam lambung
#2. Basa
Basa adalah senyawa yang mengandung gugus hidroksil (OH-), yang ketika dilarutkan dengan air maka akan menghasilkan busa, licin dan berasa pahit.
Klasifikasi Basa
Basa dibedakan menjadi 2 macam, yaitu Basa Kuat dan Basa Lemah.
Adapun pemanfaatan basa dalam kehidupan sehari - hari adalah sebagai bahan pemutih, bahan pembuatan pupuk, bahan pembersih oven, dan bahan pembuatan sabun maupun sampo.
Beberapa contoh basa yang dapat kita temui dalam kehidupan sehari - hari adalah ssbagai berikut:
1). Aluminium Hidroksida (Al(OH)3), Basa yang terdapat pada obat sakit lambung (Magh) dan deodoran.
2). Kalsium hidroksida (Ca(OH)2), Basa Kuat yang terdapat pada plester.
3). Natrium hidroksida (NaOH) atau Soda api, Basa Kuat yang terdapat pada sabun cuci dan pembersih saluran air.
4). Magnesium hidroksida (Mg(OH)2), Basa yang terdapat pada obat pencahar dan antasida untuk sakit lambung.
5). Amonia (NH3), Basa Kuat yang terdapat pada kotoran hewan, pupuk, dan baham pembersih logam.
#3. Garam
Garam adalah senyawa ion logam dengan ion sisa asam. Garam dihasilkan dari reaksi antara Logam dengan Asam, bisa juga dari Asam dengan Basa.
Untuk rekasi Asam dengan Logam akan menghasilkan Garam dan gas Hidrogen (H2).
Sedangkan untuk rekasi Asam dengan Basa menghasilkan Garam dan Air (H2O). Reaksi ini disebut juga Reaksi Penetralan.
Berikut adalah beberapa contoh Garam:
A. Reaksi Asam dengan Logam
1). H2SO4 + Fe -> FeSO4 + H2
2). H2SO4 + Pb -> PbSO4 + H2
3). H2SO4 + Mg -> MgSO4 + H2
B. Reaksi Asam dengan Basa
1). HCl + NaOH -> NaCl + H2O
2). H2SO4 + 2KOH -> K2SO4 + 2H2O
3). 2HCl + Ca(OH)2 -> CaCl2 + 2H2O
Pengelompokan Garam dibedakan menjadi 3 macam, yaitu:
1). Garam yang bersifat Asam
Persenyawaan antara Asam Kuat dengan Basa Lemah.
2). Garam yang bersifat Basa
Persenyawaan antara Asam Lemah dengan Basa Kuat.
3). Garam yang bersifat Netral
Persenyawaan antara Asam Kuat dengan Basa Kuat dan antara Asam Lemah dengan Basa Lemah.
Manfaat Garam dalam kehidupan sehari - hari adalah sebagai bahan obat untuk menetralkan asam lambung, menetralkan cairan limbah, mengurangi keasaman tanah, dan mengurangi rasa sakit pada sengatan lebah.
Mari kita bahas satu persatu dari masing - masing zat tersebut.
#1. Asam
Asam adalah senyawa yang mengandung ion Hidrogen (H+) dan karakteristiknya memiliki rasa asam. Zat ini dalam wujud cair dapat menghantarkan arus listrik.
Klasifikasi Asam
Berdasarkan asalnya, asam dibedakan menjadi 2, yaitu Asam Alami dan Asam Sintetis.
Asam alami merupakan asam yang terdapat secara alami di alam, contohnya di dalam buah dan sayur.
Sedangkan Asam sintetis merupakan asam buatan yang diproduksi oleh pabrik atau di laboratorium.
Berdasarkan tingkat keasamannya, asam dibedakan menjadi Asam Kuat dan Asam Lemah.
Asam Kuat merupakan asam yang secara umum diproduksi pabrik, disebut juga asam sintetis. Asam Lemah merupakan asam yang secara umum terdapat di dalam buah - buahan.
Asam kuat bersifat korosif, artinya senyawa golongan ini dapat merusak logam menjadi berkarat dan hancur.
Selain itu, asam kuat juga dapat merusak kulit jika terkena langsung ke permukaan kulit (melepuh).
Berikut adalah contoh senyawa asam yang sering kita temukan dalam kehidupan sehari - hari.
1). Asam asetat/ cuka (CH3COOH), Asam Lemah yang terdapat pada larutan cuka.
2). Asam askorbat (C6H8O6), Asam Lemah yang terdapat pada buah jeruk, tomat, dan vitamin C.
3). Asam sitrat (C6H8O7), Asam Lemah yang terdapat pada jeruk dan permen.
4). Asam karbonat (H2CO3), Asam Kuat yang terdapat pada minuman.
5). Asam nitrat (HNO3), Asam Kuat yang terdapat pada pupuk.
6). Asam fosfat (H3PO4), Asam Kuat yabg terdapat pada detergen dan pupuk.
7). Asam formiat (HCOOH), Asam Lemah yang terdapat pada sengatan lebah.
8). Asam laktat (C3H6O3), Asam Lemah yang terdapat pada keju dan yoghurt.
9). Asam borat (H3BO3), Asam Lemah yang terdapat pada larutan pencuci mata.
10). Asam malat (C4H6O5), Asam Lemah yang terdapat pada apel.
11). Asam sulfat (H2SO4), Asam Kuat yang terdapat pada cairan aki.
12). Asam klorida (HCl), Asam Kuat yang terdapat pada lambung, disebut juga asam lambung
#2. Basa
Basa adalah senyawa yang mengandung gugus hidroksil (OH-), yang ketika dilarutkan dengan air maka akan menghasilkan busa, licin dan berasa pahit.
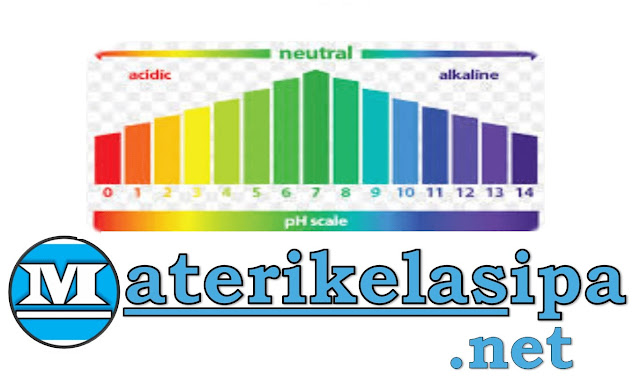 |
| Indikator Universal (Salah Satu Alat untuk Mengetahui Perbedaan Asam Basa dan Garam) |
Klasifikasi Basa
Basa dibedakan menjadi 2 macam, yaitu Basa Kuat dan Basa Lemah.
Adapun pemanfaatan basa dalam kehidupan sehari - hari adalah sebagai bahan pemutih, bahan pembuatan pupuk, bahan pembersih oven, dan bahan pembuatan sabun maupun sampo.
Beberapa contoh basa yang dapat kita temui dalam kehidupan sehari - hari adalah ssbagai berikut:
1). Aluminium Hidroksida (Al(OH)3), Basa yang terdapat pada obat sakit lambung (Magh) dan deodoran.
2). Kalsium hidroksida (Ca(OH)2), Basa Kuat yang terdapat pada plester.
3). Natrium hidroksida (NaOH) atau Soda api, Basa Kuat yang terdapat pada sabun cuci dan pembersih saluran air.
4). Magnesium hidroksida (Mg(OH)2), Basa yang terdapat pada obat pencahar dan antasida untuk sakit lambung.
5). Amonia (NH3), Basa Kuat yang terdapat pada kotoran hewan, pupuk, dan baham pembersih logam.
#3. Garam
Garam adalah senyawa ion logam dengan ion sisa asam. Garam dihasilkan dari reaksi antara Logam dengan Asam, bisa juga dari Asam dengan Basa.
Untuk rekasi Asam dengan Logam akan menghasilkan Garam dan gas Hidrogen (H2).
Sedangkan untuk rekasi Asam dengan Basa menghasilkan Garam dan Air (H2O). Reaksi ini disebut juga Reaksi Penetralan.
Berikut adalah beberapa contoh Garam:
A. Reaksi Asam dengan Logam
1). H2SO4 + Fe -> FeSO4 + H2
2). H2SO4 + Pb -> PbSO4 + H2
3). H2SO4 + Mg -> MgSO4 + H2
B. Reaksi Asam dengan Basa
1). HCl + NaOH -> NaCl + H2O
2). H2SO4 + 2KOH -> K2SO4 + 2H2O
3). 2HCl + Ca(OH)2 -> CaCl2 + 2H2O
Pengelompokan Garam dibedakan menjadi 3 macam, yaitu:
1). Garam yang bersifat Asam
Persenyawaan antara Asam Kuat dengan Basa Lemah.
2). Garam yang bersifat Basa
Persenyawaan antara Asam Lemah dengan Basa Kuat.
3). Garam yang bersifat Netral
Persenyawaan antara Asam Kuat dengan Basa Kuat dan antara Asam Lemah dengan Basa Lemah.
Manfaat Garam dalam kehidupan sehari - hari adalah sebagai bahan obat untuk menetralkan asam lambung, menetralkan cairan limbah, mengurangi keasaman tanah, dan mengurangi rasa sakit pada sengatan lebah.